近日,我所分子探针与荧光成像研究组(1818组)徐兆超研究员团队发展了在酸性条件下,可自闪烁的单分子定位超分辨成像荧光探针LysoSR-549,实现了在12nm/20ms时空分辨率下,长达40分钟的全细胞溶酶体解析。
长时间超分辨荧光成像对于揭示纳米尺度的细胞器动力学和功能越来越重要,但由于缺乏高度光稳定和环境敏感的荧光探针为研究工具,一直以来,科研人员对细胞器互作网络的功能和调节机制,尤其是细胞器纳米级全景分布和时空过程所知尚少。
溶酶体是多功能细胞器,在降解生物分子、介导细胞代谢和细胞信号传导中发挥作用。溶酶体功能障碍在溶酶体贮积症、神经退行性疾病和癌症中的作用也已得到证实,使得溶酶体成为疾病治疗靶点之一。溶酶体多重功能是通过溶酶体与其他细胞器的融合或接触来实现,并由溶酶体动力学介导,包括溶酶体的运动、溶酶体数量、大小、形态和腔内酸性变化等。越来越多的证据表明,每个具有不同位置、运动轨迹和化学成分的溶酶体都具有特定的功能;但溶酶体又同时受到系统水平上的调节,以溶酶体簇等集体行为在整个细胞内发挥功能。破译全细胞溶酶体的空间分布、化学成分和动力学可以了解和发现溶酶体的多功能和作用网络,解析溶酶体个体功能与系统调控之间的关系。但溶酶体腔内是pH为4.5至5的酸性环境,使得荧光探针无法在此条件下实现长时间的时空超分辨和对溶酶体酸性的动态识别。
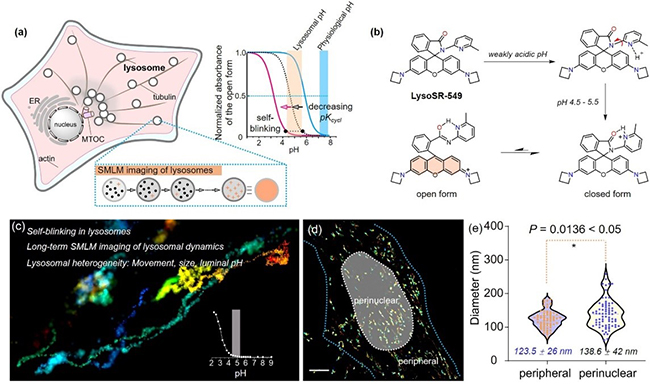
本工作中,该团队将邻甲基吡啶引入到罗丹明螺酰胺中,开发了自闪烁探针LysoSR-549。研究发现,吡啶与异吲哚啉酮处于平面结构,并且吡啶N与羰基处于反式构型。由于吡啶的碱性大于羰基,因此在弱酸性下,质子优先与吡啶N结合而远离羰基;随着酸度的增加,吡啶环旋转,质子同时与羰基结合,使pH在4.5至5范围内的少量染料发生开环反应,形成荧光两性离子;随后又与呫吨环10号位-C发生亲核加成反应,迅速恢复为不发荧光的螺内酰胺,从而完成一次闪烁过程。
基于上述反应机理,LysoSR-549自闪烁参数pKcycl被降低到3.2,使其能够在溶酶体pH下进行单分子定位超分辨成像(SMLM),并达到了12nm/20ms时空分辨率,这是目前所报道的溶酶体超分辨成像中最高的定位精度。同时,溶酶体内负载了大量的探针,由于只有少数探针处于闪烁发光状态,这就赋予了探针缓冲能力来抵抗光漂白,使得LysoSR-549呈现出较好的光稳定性,实现了40分钟的长时间超分辨率成像,从而在单个溶酶体分辨的水平上解析了全细胞内所有溶酶体的运动轨迹,包括观察到最长运动距离可达50μm,最快运动速度可达0.31μm/s。该探针的单分子光子数与pH值呈线性关系,从而可以在单分子成像过程中识别每个溶酶体pH值,最终实现了单个溶酶体解析水平上,同时分辨整个细胞中所有溶酶体的动态和腔内pH,并根据溶酶体分布、大小和腔内pH值来分辨出全细胞溶酶体亚群。
LysoSR-549所具备的解析全细胞溶酶体的能力,使得立体可视化追踪和分辨溶酶体成为可能,从而可以发现很多之前未知的溶酶体化学和生物学信息,破解溶酶体的生物化学。团队实现了对整个细胞的所有溶酶体跨时间尺度追踪,也可以聚焦在某一局部,或某一个溶酶体来做研究。
此外,该团队还对不同外界刺激下的全细胞溶酶体进行了分析,发现不同条件下溶酶体的大小、数量、分布、动力学和腔内pH值均有显著差异,这可望对溶酶体相关疾病诊断提供新的方法。
相关研究成果以“An Acid-regulated Self-blinking Fluorescent Probe for Resolving Whole-cell Lysosomes with Long-term Nanoscopy”为题,于近日发表在《德国应用化学》(Angew. Chem. Int. Ed.)上。该工作的第一作者是我所1818组乔庆龙副研究员。上述工作得到国家自然科学基金、我所创新基金等项目的资助。(文/图 乔庆龙)
原文链接:https://doi.org/10.1002/anie.202202961